Cara Membuat Mailing List (Milis) dengan gmail
Pada kesempatan kali ini saya akan membagikan tips dan trik cara membuat Mailing List Mailing List juga sering diistilahkan sebagai milis, yaitu sebuah alamat email yang digunakan oleh sekelompok pengguna internet untuk melakukan kegiatan tukar menukar informasi. Setiap pesan yang dikirimkan ke alamat sebuah milis, secara otomatis akan diteruskan ke alamat email seluruh anggotanya. Milis umumnya dimanfaatkan sebagai sarana diskusi atau pertukaran informasi diantara para anggotanya.
Pengelompokan alamat e-mail. Artinya, apabila suatu surat dikirimkan ke alamat ini, maka secara otomatis sistem akan mengirimkannya kepada alamat-alamat yang telah didaftarkan dalam database mesin tersebut, dengan adanya mailing list ini, apabila satu surat ingin dikirimkan ke beberapa orang, maka cukup dikirimkan ke mailing list. Metode pengiriman email juga dapat diset apakah setiap email yang dikirimkan oleh anggota dapat diterima atau cukup diterima sekaligus (digest).
Pengaturan diskusi melalui mailing list ini dapat diset dalam bentuk moderated atau unmoderated tergantung siapa saja yang boleh berkomentar dan ikut berdiskusi. Pengaturan diskusi dilakukan oleh seorang moderator.
Untuk Cara membuatnya adalah sebagai berikut :
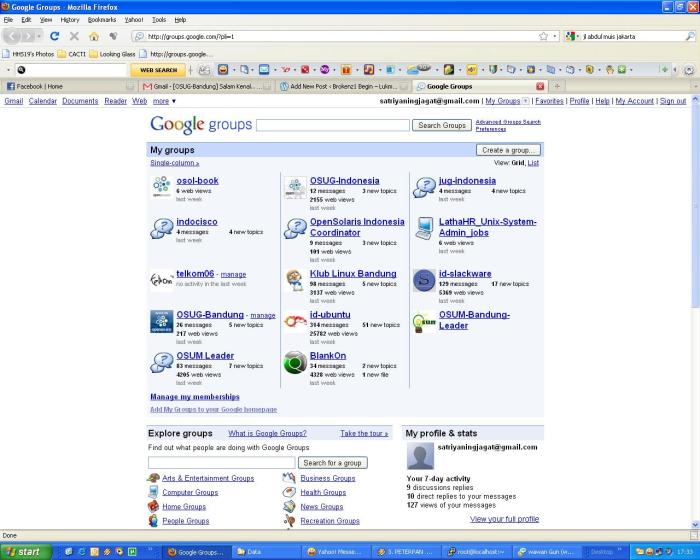
1. Buat account gmail dulu kalau belum punya account gmail, kalau sudah langsung ke step berikutnya
3. create a group dan ikuti step berikutnya.
4. Isilah nama group dengan benar dan otomatis akan menjadi alamat groups kita nantinya. Selanjutnya isi deskripsi dari milis anda dengan maksimal 300 huruf. Checklist this group may content adult … jika anda menginginkan milis ini khusus untuk golongan yang berumur sudah dewasa. Terakhir pilih akses level yang anda inginkan, pada contoh disini saya memilih public yang artinya semua orang bisa membaca archives kita dan join ke group tapi hanya member yang bisa buat posting dan melihat member serta hanya managers lah yang bisa membuat halaman baru dan upload file. Jika sudah benar tinggal klik Create my group. Ikuti step berikutnya.
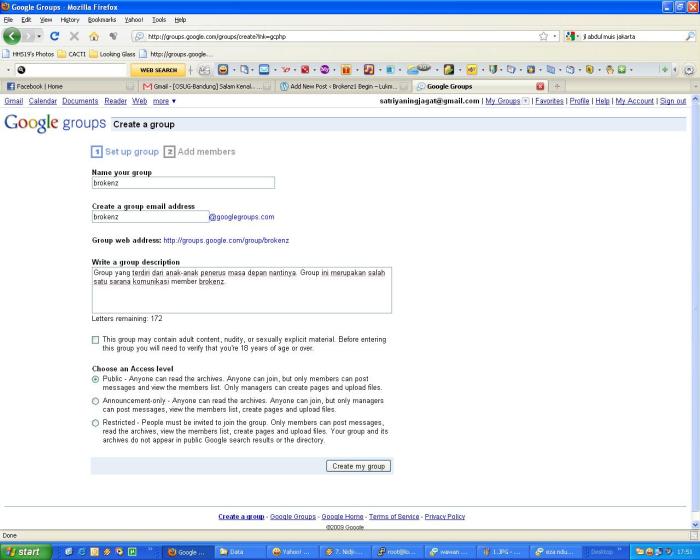
style="font-family: Trebuchet MS, sans-serif;">5 Masukkan kata sandi yang ada dan klik Create my group.
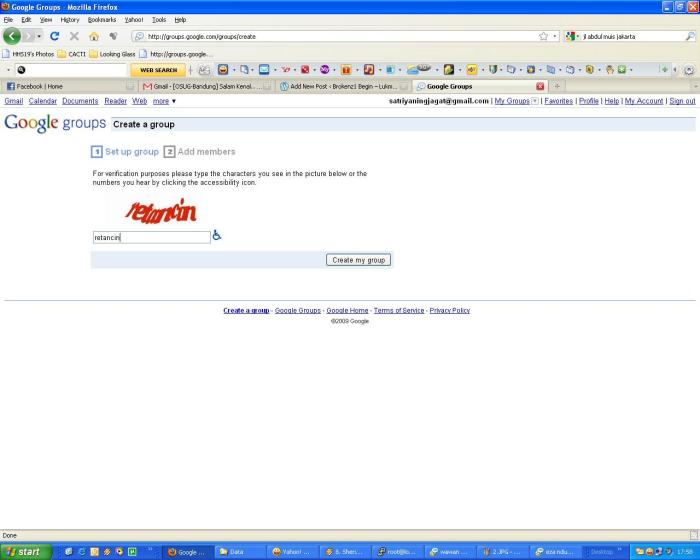
6. Pada langkah ini kita bisa invite member yang kita inginkan. Ada dua mode, pertama Invite member by emailyang artinya member nanti harus join sendiri ke link yang sudah kita kasih secara otomatis dari mesin google. Kedua Add member directly artinya email yang kita masukkan langsung menjadi member (terutama member yang mempunyai email yahoo saya lebih suka cara yang ini). Dalam contoh saya memakai mode kedua. Note: wellcome message jangan terlalu singkat.

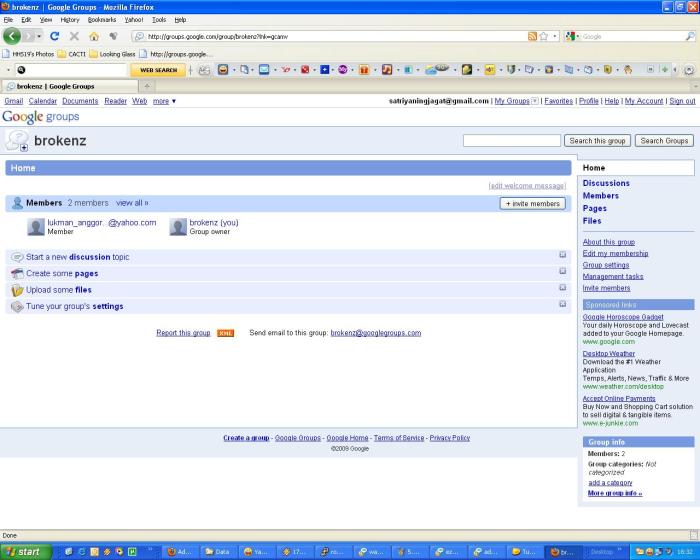
7. Selamat sampai sini kita sudah berhasil membuat milis dengan google. Klik visit your new groups.

8. Ini adalah halaman google groups anda,
Demikian Artikel yang dapat saya tulis semoga artikel ini bermanfaat bagi anda semua.